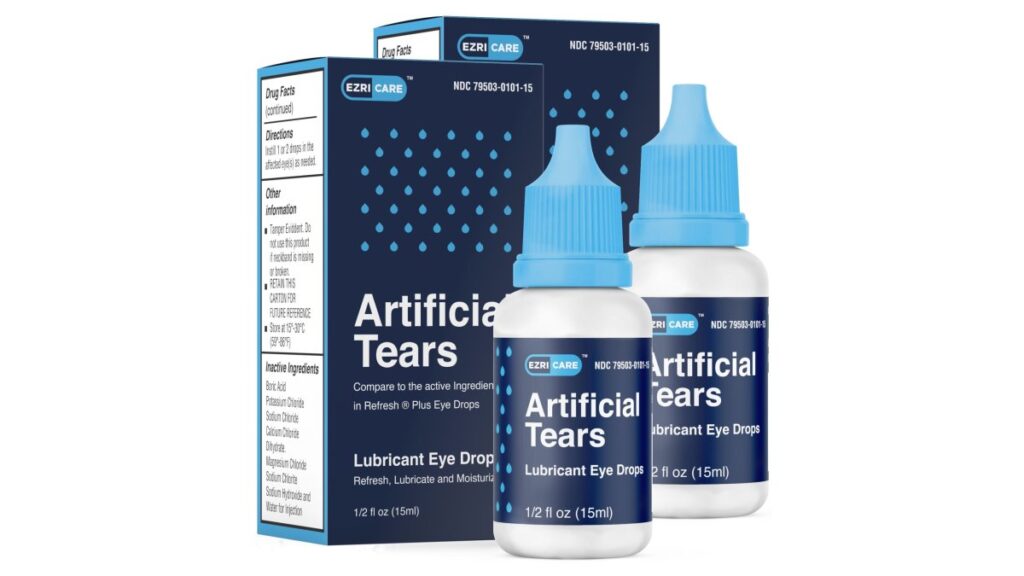
WASHINGTON DC — El fabricante de gotas para los ojos vinculado recientemente con muertes y lesiones carecía de medidas para garantizar la esterilidad en su fábrica en India, según inspectores de salud de Estados Unidos.
Los funcionarios de la Administración de Drogas y Alimentos descubrieron alrededor de una docena de problemas con la forma en que Global Pharma Healthcare fabricaba y probaba sus gotas para los ojos durante una inspección desde fines de febrero hasta principios de marzo. La FDA publicó su informe de inspección preliminar el lunes.
La compañía utiliza procedimientos que en realidad no pueden garantizar que sus productos sean estériles, escribió el personal de la FDA. En particular, los inspectores encontraron que la planta había utilizado “un proceso de fabricación deficiente” entre diciembre de 2020 y abril de 2022 para productos que luego se enviaron a los EEUU.
La planta en el estado de Tamil Nadu, en el sur de la India, produjo gotas para los ojos que se han relacionado con 68 infecciones bacterianas en los EEUU, incluidas tres muertes y ocho casos de pérdida de la visión. A cuatro personas se les extirparon quirúrgicamente los globos oculares debido a una infección. Las gotas fueron retiradas del mercado en febrero por dos distribuidores estadounidenses, EzriCare y Delsam Phama.
El brote se considera particularmente preocupante porque la bacteria que lo provoca es resistente a los antibióticos estándar.
Los inspectores llegaron a la planta el 20 de febrero, más de dos semanas después del anuncio del primer retiro de gotas para los ojos el 3 de febrero. La inspección parece ser la primera visita de la FDA a la planta, según los registros de la agencia.
El informe contiene los hallazgos preliminares de la agencia y es probable que le siga un informe formal y una carta de advertencia a la empresa. Un portavoz de la FDA dijo que la inspección indica que los productos de la compañía “pueden estar violando los requisitos de la FDA”.
“Instamos a los consumidores a que dejen de usar estos productos que pueden ser dañinos para su salud”, escribió Jeremy Khan de la FDA en un comunicado enviado por correo electrónico.
La FDA es responsable de garantizar la seguridad de los productos extranjeros enviados a los EEUU, aunque durante mucho tiempo ha luchado para seguir el ritmo de las cadenas de suministro farmacéuticas internacionales que comienzan cada vez más en India y China.
Los inspectores de la FDA citaron condiciones sanitarias preocupantes en la planta de Global Pharma y señalaron que sus pisos, paredes y techos no eran “fáciles de limpiar”. En un momento durante la visita, un inspector de la FDA notó que “ninguno de los equipos de la máquina llenadora estaba envuelto o cubierto”. El inspector también señaló que la empresa no tenía procedimientos rigurosos para garantizar que las botellas estuvieran completamente selladas. En cambio, una “inspección visual manual es la única prueba para detectar cualquier fuga”, según el informe.
Global Pharma ha dicho poco públicamente sobre sus retiros recientes, en lugar de eso, remitió las preguntas a las empresas estadounidenses que vendieron los productos.
La FDA ha estado investigando las infecciones bacterianas de EEUU junto con los Centros para el Control y la Prevención de Enfermedades. Los funcionarios de los CDC detectaron la cepa bacteriana en botellas abiertas de gotas EzriCare recolectadas de pacientes infectados. Los funcionarios de la FDA también están probando botellas sin abrir de las gotas.
Los funcionarios de los CDC están preocupados de que la bacteria se propague y se puedan informar casos durante las próximas semanas y meses. La agencia ha estado instando a los centros de atención médica que tratan a los pacientes a seguir recomendaciones estrictas de control de infecciones porque el germen puede propagarse rápidamente.
Source link