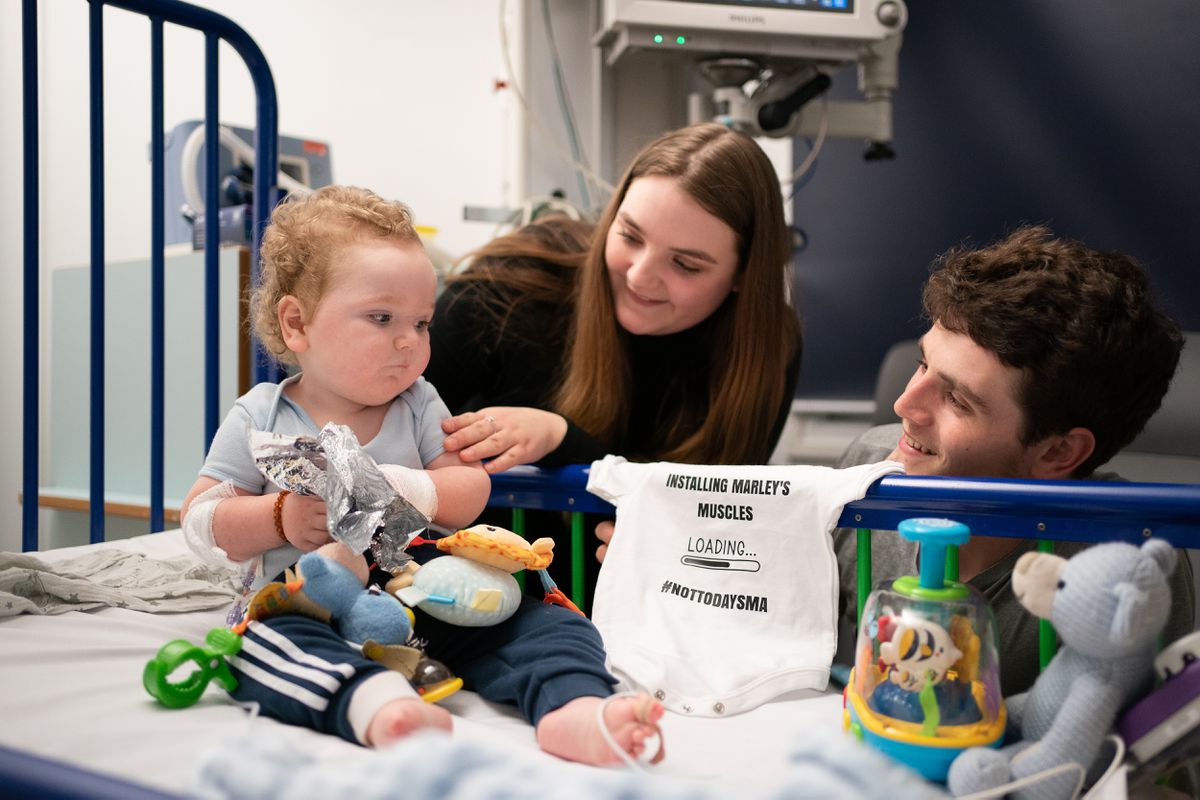
La farmacéutica suiza Novartis y el Ministerio de Sanidad negocian desde principios de año la financiación pública de un innovador medicamento para tratar la atrofia muscular espinal, una rara dolencia genética que impide el desarrollo motor de los recién nacidos y que en las formas más graves reduce su esperanza de vida a apenas dos años. Se trata del Zolgensma, una terapia génica que ha sido calificada como “el fármaco más caro del mundo”, por el que la compañía pide un precio de partida de 1,95 millones de euros por una sola inyección intravenosa.
La causa de la enfermedad es un gen defectuoso que impide al organismo producir una proteína que protege a las neuronas motoras, responsables de la fuerza muscular que permite erguirse, caminar, respirar, tragar y otras funciones vitales. Sin estas proteínas, las neuronas mueren y los niños no logran desarrollarse de forma autónoma. “El medicamento se administra con una sola inyección intravenosa que introduce el gen y hace posible que el organismo palie esta carencia”, explica Vicente Arocas, de la Sociedad Española de Farmacia Hospitalaria (SEFH). Cada año nacen entre 30 y 40 niños con atrofia muscular espinal en España –es por tanto una enfermedad rara– y es importante que reciban el tratamiento de forma precoz, ya que una vez desarrollados los síntomas más importantes es prácticamente imposible revertirlos.
El Zolgensma supone una mejora terapéutica sustancial, ya que las opciones de tratamiento disponibles son muy limitadas y el fármaco aumenta de forma notable el desarrollo y la supervivencia de los pacientes, según los ensayos aportados por Novartis a los organismos reguladores. Arocas recuerda, sin embargo, que aún quedan cuestiones por resolver: “A diferencia de los CAR-T, que pueden curar algunos tipos de cáncer hematológico en un plazo de 12 o 18 meses, esta es una enfermedad crónica en la que el niño va evolucionando y debemos ir comprobando que la eficacia esperada se cumple”.
La Agencia Europea del Medicamento aprobó el fármaco en marzo de 2020. Lo hizo mediante una “autorización condicional”, vía que permite una llegada más rápida de los tratamientos innovadores a los sistemas sanitarios, pero que también “exige a las compañías aportar información adicional sobre los beneficios y riesgos” observados a medida que más pacientes los reciben.
El Zolgensma es el último ejemplo de medicamento puntero que permite hacer frente con esperanza a enfermedades hasta ahora incurables, pero que cada vez son más caros. Esto ha disparado la preocupación por la sostenibilidad de los sistemas sanitarios y puesto el foco en las políticas de precios de la industria farmacéutica. Sanidad ha acordado en los dos últimos años financiar tratamientos como los CAR-T Kymriah y Yescarta (320.000 euros), Luxturna (indicado para la pérdida de visión, 345.000 euros) y Spinraza (también contra la atrofia muscular espinal, a 70.000 euros el vial).
En todos los casos, Sanidad ha impuesto mecanismos que buscan compatibilizar la incorporación al sistema de los tratamientos más innovadores con el control de una factura farmacéutica que amenaza con desbordarse ante la prevista llegada de nuevos fármacos de estas características en los próximos años. Uno de ellos es el de pago por resultados, en el que la retribución a la farmacéutica se fracciona y la sanidad pública realiza los sucesivos abonos solo si los pacientes experimentan una mejoría. Otro es el llamado techo de gasto, que fija un importe máximo a pagar según una estimación del número de pacientes que recibirán el tratamiento.
“Son fórmulas adecuadas si tenemos en cuenta que el momento de introducir un nuevo medicamento es el de mayor incertidumbre sobre su efectividad”, explica Juan Oliva, profesor de Economía de la Salud en la Universidad de Castilla-La Mancha. “Es cuando solo se dispone de la información de los ensayos, pero aún no se sabe si se cumplirán en la vida real”.
Este sistema, sin embargo, no está libre de otros problemas, añade Oliva. “Estos acuerdos son usados por muchos países de la OCDE [Organización para la Cooperación y el Desarrollo Económicos], pero tienen el inconveniente de que siempre acaban con acuerdos confidenciales. Esto impide que la experiencia acumulada por cada gobierno pueda ser compartida. Con procedimientos tan opacos no es posible aprender unos de otros, ni saber qué está funcionando mejor”.
Francesc Puigventós, de la Asociación para la Defensa de la Sanidad Pública de las Islas Baleares y con décadas de experiencia en la farmacia hospitalaria, critica que los precios de los nuevos fármacos “ya no tienen relación con los costes de investigación y producción, que las compañías mantienen en secreto”. “En realidad, las farmacéuticas muchas veces analizan cuánto puede estar dispuesto a pagar cada sistema sanitario, fijan de partida un precio oficial elevado y luego pueden ir rebajándolo un poco según el país, aunque esto no lo sabemos porque todo es confidencial”, añade.

En España, tres fuentes del sector coinciden en apuntar que los descuentos logrados por la sanidad pública “sobre el precio oficial solicitado por la compañía pueden oscilar entre el 10% y el 20%”, aunque lo cierto es que la opacidad de los contratos impide contrastar estas valoraciones.
Novartis defiende el precio del Zolgensma: “Más allá de lo que supone a corto plazo financiar un medicamento innovador, los recursos que el Estado dedica a su financiación constituyen una inversión a medio y largo plazo que genera un retorno mayor para el paciente y para la sociedad en su conjunto, tanto en términos de aumento de la esperanza de vida y de la calidad de los años vividos como en ahorro de otros recursos sanitarios derivados de la utilización de estos nuevos fármacos”.
Las negociaciones sobre el Zolgensma en España parecían encarriladas en abril, cuando la Comisión Interministerial de Precios de los Medicamentos (CIPM) ―en la que también participan las comunidades autónomas― dio luz verde a su financiación con varias condiciones para mitigar su impacto en las cuentas públicas, una de ellas el modelo de “pago por resultados”.
La propuesta de financiación aprobada en abril preveía varios hitos que el tratamiento debía lograr a los 18, 30, 42, 54 y 66 meses de la administración del fármaco, como que los niños fueran capaces de mantenerse sentados, caminar, respirar y alimentarse de forma autónoma. También contemplaba una “revisión anual de las ventas y precios” para proceder a una rebaja “si se superan las previsiones de la compañía”. Pero Novartis no ha aceptado estas condiciones y ha presentado alegaciones. Las negociaciones siguen ahora en marcha sin que hayan trascendido más detalles.
“El procedimiento de financiación de Zolgensma se encuentra aún en curso”, responde por escrito un portavoz de Novartis. “Es un expediente que se llevará a la Comisión y hasta que no se celebre no podemos avanzar más datos”, responde por su parte un portavoz de Sanidad. Las próximas reuniones de la CIPM están previstas para el 28 de octubre y el 25 de noviembre.
Acuerdo cercano
Fuentes del sector afirman que “el acuerdo está cercano” y confían en que en estos dos meses “se pueda incorporar sin más retrasos el Zolgensma a la sanidad pública”. Mientras, explican estas fuentes, “dos niños, uno de ellos en Baleares, ya han recibido el tratamiento por la vía de medicamentos en situaciones especiales”, una fórmula que permite a la sanidad pública acceder a fármacos aún no financiados por el Sistema Nacional de Salud (SNS).
Novartis explica que aún es pronto para conocer los resultados terapéuticos de sus dos primeros pacientes en España: “Los tratamientos se han administrado hace aproximadamente un mes y están pendientes de evaluación completa por sus médicos”.
Estos dos casos, sin embargo, están lejos de las previsiones realizadas sobre cuántos bebés podrían beneficiarse del Zolgensma. Según Novartis, “cada año nacen en España unos 36 niños con atrofia muscular espinal, siendo unos 18 los que presentan el fenotipo 1 que es el de mayor gravedad y con peor pronóstico si no se trata”.
Esta estimación es similar a la realizada por el grupo de trabajo Génesis, de la SEFH. “Nuestros cálculos son que para el tipo 1 habría entre 18 y 22 niños al año. El segundo tipo de pacientes para los que el medicamento está indicado, aún sin síntomas pero cuyo diagnóstico puede lograrse porque un hermano sí los tiene, serían unos 14″, explica Vicente Arocas.
Las familias afectadas esperan ansiosas a que se resuelva la situación. Mencía de Lemus, madre de dos niños con la enfermedad y presidenta de la Fundación Atrofia Muscular Espinal (Fundame), califica de “desorbitado” el precio fijado por Novartis, pero también se muestra crítica con la posición de Sanidad. “El ministerio mantiene unos criterios de acceso al fármaco más restrictivos que los de la Agencia Europea del Medicamento. Y en el programa de pago por resultados exige una mejora que en algunos casos va más allá de lo obtenido en los ensayos. El riesgo es que se queden fuera unos niños con una necesidad dramática de terapias y que sin un buen acuerdo no van a recibirla”, lamenta.