El mundo del descubrimiento de fármacos impulsado por IA sigue expandiéndose a medida que crecen las capacidades del aprendizaje automático. Un enfoque que parecía impensable hace solo unos años es simular las interacciones complicadas de dos moléculas entrelazadas, pero eso es exactamente lo que los diseñadores de fármacos necesitan saber y exactamente lo que necesitan. Terapéutica del encanto pretende hacer con su plataforma DragonFold.
Las proteínas hacen casi todo lo que vale la pena hacer en su cuerpo y son los objetivos más frecuentes de las drogas. Y para crear un efecto, primero debe comprender ese objetivo, específicamente cómo la cadena de aminoácidos que forman la proteína se “pliega” en diferentes circunstancias.
En el pasado reciente, esto a menudo se hacía con cristalografía de rayos X compleja y que requería mucho tiempo, pero recientemente se demostró que los modelos de aprendizaje automático como AlphaFold y RoseTTAFold son capaces de producir resultados igual de buenos pero en segundos en lugar de semanas o meses.
El próximo desafío es que incluso si sabemos cómo se pliega una proteína en sus condiciones más comunes, no sabemos cómo podría interactuar con otras proteínas, y mucho menos con nuevas moléculas creadas específicamente para unirse a ellas. Cuando una proteína se encuentra con un aglutinante o ligando compatible, puede transformarse por completo, ya que pequeños cambios pueden activarse en cascada y reconfigurar toda su estructura; en la vida, esto lleva a cosas como una proteína que abre un pasaje hacia una célula o expone una nueva superficie que activa otras proteínas , y así.
“Ahí es realmente donde hemos innovado: hemos creado DragonFold, que es el primer algoritmo de plegado conjunto de proteínas y ligandos”, dijo Laskh Aithani, director ejecutivo y cofundador de Charm Therapeutics.
“Diseñar medicamentos que se unan a la proteína de interés causante de la enfermedad de manera muy estrecha y selectiva (es decir, que eviten unirse a otras proteínas similares que se requieren para el funcionamiento humano normal) es de suma importancia”, explicó. “Esto se hace más fácilmente cuando se sabe exactamente cómo estos medicamentos se unen a la proteína (la forma 3D exacta del ligando unido a la proteína que causa la enfermedad). Esto permite realizar modificaciones de precisión en el ligando para que pueda unirse de manera más fuerte y selectiva”.
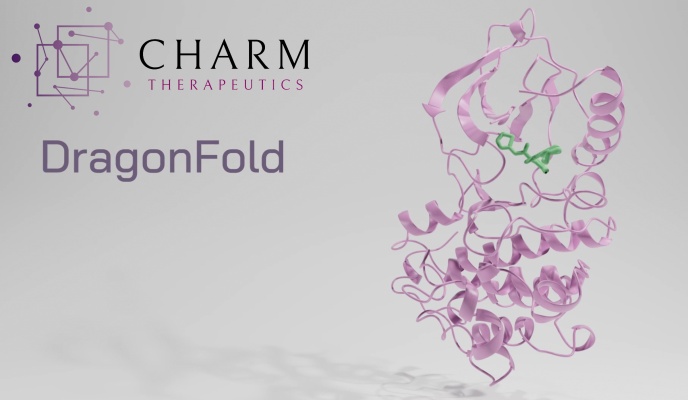
Puede ver una representación de esta situación en la parte superior del artículo: la pequeña molécula verde y la proteína morada encajan de una manera muy específica que no es necesariamente intuitiva o fácil de predecir. La simulación eficaz y eficiente de este proceso ayuda a examinar miles de millones de moléculas, de forma similar a los procesos anteriores que identificaron candidatos a fármacos, pero yendo más allá y reduciendo la necesidad de comprobar experimentalmente si interactúan como se esperaba.
Para lograr esto, Aithani recurrió a David Baker, diseñador del algoritmo RoseTTAFold entre muchos otros y director de una laboratorio influyente en la Universidad de Washington, para ser su co-fundador. Baker es bien conocido en la academia y la industria como uno de los principales investigadores en esta área y ha publicado numerosos artículos sobre el tema.
Los cofundadores de Charm Therapeutics, Laskh Aithani (izquierda) y David Baker. Créditos de imagen: Terapéutica del encanto
Poco después de que se demostrara que los algoritmos podían predecir estructuras de proteínas en función de su secuencia, Baker estableció que también podían “alucinar” nuevas proteínas que actuaban como se esperaba in vitro. Él está muy claramente en la vanguardia aquí. Y ganó un premio Breakthrough de $ 3 millones en 2020, definitivamente hasta convertirse en cofundador técnico. Aithani también destacó con orgullo la presencia del veterano de DeepMind, Sergey Bartunov, como director de IA, y la exlíder de investigación farmacéutica, Sarah Skerratt, como directora de descubrimiento de fármacos.
La ronda A de $50 millones fue liderada por F-Prime Capital y OrbiMed, con la participación de General Catalyst, Khosla Ventures, Braavos y Axial. Si bien cantidades tan grandes no son infrecuentes para las nuevas empresas de software, se debe tener en cuenta que Charm no se detiene en desarrollar la capacidad de caracterizar estas interacciones proteína-ligando.
La financiación inicial de la empresa se utilizó para construir el modelo, pero ahora avanzan al siguiente paso: la identificación positiva de medicamentos efectivos.
“Tenemos la versión inicial [of the model] listo, y eso ha sido validado in-silico”, dijo Aithani. “Durante los próximos trimestres, lo estamos validando experimentalmente. Tenga en cuenta que el ‘producto’ será principalmente para uso interno para ayudar a nuestros propios científicos a descubrir medicamentos potenciales de los que poseemos el 100% de los derechos”.
Por lo general, el proceso de prueba implica la detección en un laboratorio húmedo de miles y miles de moléculas candidatas, pero si funciona como se anuncia, DragonFold debería reducir enormemente ese número. Eso significa que un laboratorio relativamente pequeño con un presupuesto relativamente pequeño puede encontrar un medicamento que hace unos años podría requerir que una importante compañía farmacéutica invirtiera cientos de millones.
Teniendo en cuenta el perfil de beneficios de un nuevo fármaco, no sorprende que la empresa haya atraído este tipo de inversión: unas pocas decenas de millones es una gota en el océano en comparación con el presupuesto de I+D de cualquier gran empresa de investigación biotecnológica. Todo lo que se necesita es un golpe y se están riendo. Todavía toma un tiempo, pero el descubrimiento de drogas de IA también acorta los plazos, así que espere escuchar acerca de sus primeros candidatos más temprano que tarde.
Source link