La industria biotecnológica está experimentando una avalancha de herramientas impulsadas por IA para muchos aspectos del complejo proceso de descubrimiento de fármacos. Pero uno que ha pasado desapercibido, cada vez más considerado como clave para ciertas enfermedades pero lamentablemente poco estudiado, es el ARN. Con $35 millones en nuevos fondos, IA atómica tiene como objetivo hacer con el ARN lo que AlphaFold hizo con las proteínas y encontrar tratamientos completamente nuevos en el proceso.
Si aún puede recordar su biología de la escuela secundaria, probablemente recuerde el ARN como una especie de intermediario entre el ADN (almacenamiento de información a largo plazo) y las proteínas (la maquinaria de la vida celular a nivel molecular). Pero como la mayoría de las cosas en la naturaleza, no parece ser tan simple, explicó el CEO y fundador de Atomic AI, Raphael Townshend.
“Existe este dogma central de que el ADN va al ARN, que va a las proteínas. Pero en los últimos años ha surgido que hace mucho más que codificar información”, dijo en una entrevista con TechCrunch. “Si miras el genoma humano, alrededor del 2% se convierte en proteína en algún momento. Pero el 80 por ciento se convierte en ARN. Y está haciendo… ¿quién sabe qué? Está muy poco explorado”.
En comparación con el ADN y las proteínas, se ha hecho poco trabajo en esta área. La academia se ha centrado en otras piezas del rompecabezas y los productos farmacéuticos, en parte como consecuencia de eso, han buscado proteínas como mecanismos para las drogas. El resultado es una grave falta de conocimientos y datos sobre las estructuras del ARN.
Pero lo que plantea Atomic AI es que el ARN es funcional y vale la pena seguirlo como método de tratamiento. El secreto está en las regiones “no codificantes” del ARN, que son como el encabezado y el pie de página de un documento. Hacen un trabajo similar al de las proteínas, pero no son proteínas, y no son el único ejemplo.
Puedes pensar en las hebras de ARN como collares de cuentas, mucho más cuerdas que cuentas. La cadena es “floppy” y más o menos lo que sus detractores creen que es: un intermediario. Pero de vez en cuando obtienes un nudo realmente interesante que parece poco probable que se haya formado por accidente. Al igual que con las proteínas, si puede descifrar su estructura, eso ayudará en gran medida a comprender qué hacen y cómo pueden verse afectadas.
“La clave es encontrar esas perlas, esos fragmentos estructurados. Tiene un alto contenido de información, es orientable y probablemente también sea funcional”, dijo Townshend. “Se ve en el descubrimiento de fármacos como una nueva frontera clave”.
Quizás sea una idea interesante para una tesis de posgrado (y lo fue para Townshend), pero ¿cómo se puede construir un negocio en torno a ella?
Primero, si el campo está a punto de volverse más importante, desarrollar los métodos para estudiar tiene mucho valor. Luego, si construye esos métodos, puede ser el primero en la fila para usarlos. Atomic AI está haciendo ambas cosas simultáneamente.
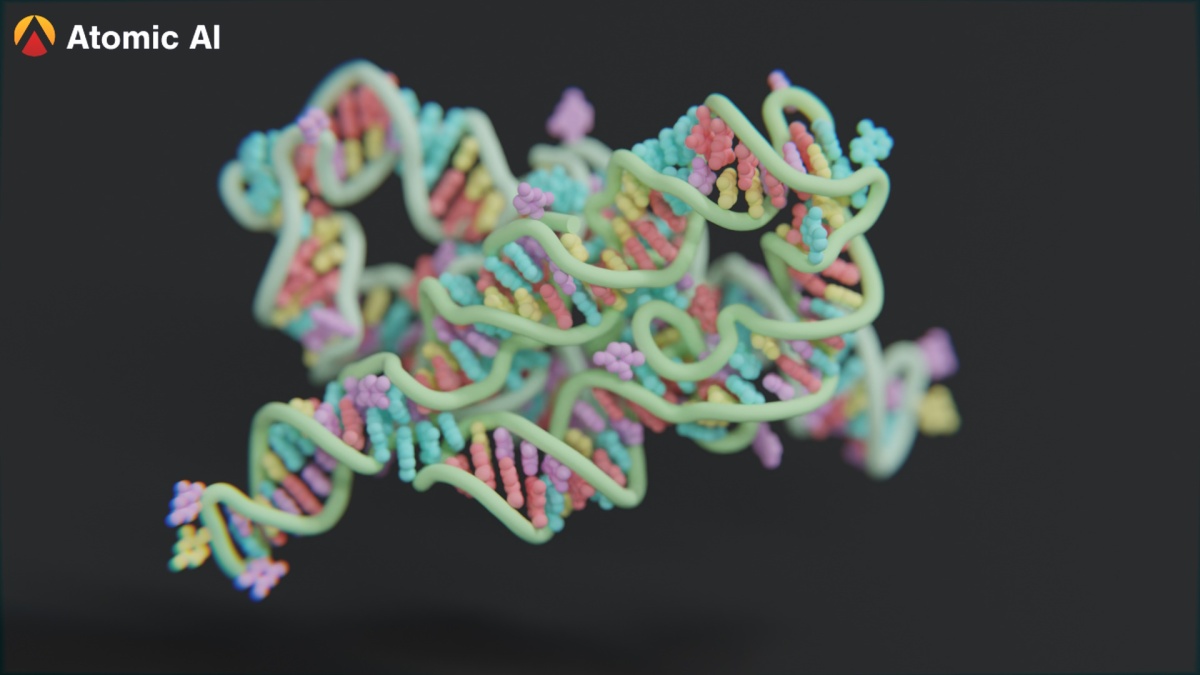
Un modelo 3D giratorio de una estructura de cadena de ARN predicha por PARSE.
El núcleo de la IP de Atomic es, aunque esto es algo así como una simplificación, un AlphaFold para ARN. La biología es diferente y la forma en que funcionan los modelos es diferente, pero la idea es la misma: un modelo de aprendizaje automático entrenado en un conjunto limitado de un tipo de molécula que puede hacer predicciones precisas sobre la estructura de otras moléculas de ese tipo.
Lo sorprendente es que el equipo de Townshend creó un modelo de este tipo, que supera a los demás por un amplio margen, alimentándolo con las características de solo 18 estructuras de moléculas de ARN “publicadas entre 1994 y 2006”. Este modelo absolutamente básico arrasó con otros, como se revela en un artículo de primera plana publicado en Science en 2021.
Desde entonces, Townshend se apresuró a agregar que la compañía ha aumentado enormemente sus modelos y métodos con más materia prima, gran parte de la cual ha creado ella misma en sus propios laboratorios húmedos. Llaman al conjunto actualizado de herramientas PARSE: Plataforma para la exploración de estructuras de ARN impulsada por IA.
“El artículo de Science representó un avance inicial, pero en realidad hemos generado una gran cantidad de… datos adyacentes a la estructura”, explicó. “No la estructura completa en sí, sino datos relacionados con la estructura, decenas de millones de puntos de datos; la misma escala de datos que necesitaría para entrenar grandes modelos de lenguaje. Y combinado con otro trabajo de aprendizaje automático, hemos podido mejorar drásticamente tanto la velocidad como la precisión del papel”.
Eso significa que Atomic AI es el único que, al menos públicamente, tiene un sistema que puede tomar los datos sin procesar de una molécula de ARN y arrojar una estimación razonablemente confiable de su estructura. Eso es útil para cualquier persona que realice investigaciones sobre el ARN dentro o fuera de la medicina, y con las terapias génicas y las vacunas de ARNm, el campo definitivamente está en aumento.
Otra estructura de ARN (pero representada de manera diferente).
Con una herramienta de este tipo, puede elegir una de dos formas: licenciarla como una plataforma de “estructura como servicio”, como lo expresó Townshend, o usarla usted mismo. Atomic ha optado por lo último y está siguiendo su propio programa de descubrimiento de fármacos.
Este enfoque tiene una diferencia notable con muchos de los procesos de descubrimiento de IA que existen. La idea general es que tiene una proteína, digamos una que desea inhibir la expresión en el cuerpo humano, pero lo que no tiene es un químico que se una de manera confiable y exclusiva a esa proteína, exactamente donde y cuando lo desea ( y barato, si es posible).
Los esfuerzos de descubrimiento de fármacos de IA tienden a producir miles, millones, incluso miles de millones de moléculas candidatas que podrían funcionar, clasificarlas y dejar que los laboratorios húmedos comiencen a trabajar en la lista lo más rápido posible. Si puede encontrar uno que cumpla con las características anteriores, puede producir un medicamento novedoso o reemplazar uno más costoso en el mercado. Pero la clave es que estás compitiendo para encontrar nuevos aglutinantes para una proteína conocida.
“No solo estamos encontrando aglutinantes, estamos encontrando lo que es objetivo en primer lugar. La razón por la que es interesante es que, al final del día, estos grandes productos farmacéuticos se preocupan más por la biología novedosa que por las moléculas novedosas. Está habilitando algo que antes no era factible al encontrar este nuevo objetivo, en lugar de aumentar la cantidad de moléculas disponibles para atacarlo”, dijo Townshend.
No solo eso, sino que se ha descubierto que algunas proteínas son casi imposibles de administrar por cualquier motivo, lo que produce enfermedades resistentes a los medicamentos. El ARN podría permitir el tratamiento de estas mismas enfermedades al acabar con la proteína problemática.
Por el momento, Atomic AI ha reducido la lista a ciertos tipos de cáncer que dan como resultado una sobreproducción patológica de proteínas (y, por lo tanto, buenas opciones para adelantarse al mecanismo) y enfermedades neurodegenerativas que también pueden beneficiarse de una intervención previa.
Por supuesto, todo este trabajo es inmensamente costoso, ya que requiere una gran cantidad de trabajo de laboratorio y una intensa ciencia de datos. Afortunadamente, la empresa ha recaudado una ronda A de 35 millones de dólares, dirigida por Playground Global, con la participación de 8VC, Factory HQ, Greylock, NotBoring, AME Cloud Ventures, así como de los ángeles Nat Friedman, Doug Mohr, Neal Khosla y Patrick Hsu. (La compañía recaudó previamente una ronda inicial de $ 7 millones).
“La gente ha recogido toda la fruta madura en la tierra de las proteínas”, dijo Townshend. “Ahora hay una nueva biología que perseguir”.
Source link