El laboratorio farmacéutico Pfizer anunció este lunes que los datos preliminares sobre su vacuna experimental frente al Covid-19 indican que ha sido efectiva en un 90%, según los datos iniciales de su estudio con miles de voluntarios en todo el mundo. Es la primera cifra de eficacia que se conoce de una de las candidatas que se encuentran en ensayos clínicos y el dato es mejor de lo esperado.
Pfizer y el socio alemán BioNTech son los primeros fabricantes de medicamentos en mostrar datos exitosos de un ensayo clínico a gran escala de una vacuna contra el coronavirus. Las compañías avanzaron que hasta ahora no han encontrado problemas serios de seguridad y esperan solicitar la autorización de uso de emergencia de EE UU a finales de este mes.
En el caso de la Unión Europea, la Agencia Europea del Medicamento (EMA, en sus siglas en inglés) está evaluando de forma continua este producto, igual que el de su rival AstraZeneca, para aprobarlo de forma automática en cuanto se tengan datos médicos suficientes de la efectividad y seguridad de estas candidatas.
En el caso de Pfizer, la Comisión Europea todavía negocia cerrar un acuerdo de suministro para los países miembros, al que previsiblemente se sumaría España como hará en el caso de AstraZeneca, Janssen y Sanofi.
El laboratorio prevé que el avance en los ensayos clínicos le permita distribuir la vacuna en la Unión Europea, y por tanto en España, antes de que finalice al año, según avanzó la compañía de Nueva York a finales de octubre en un documento para inversores.
Si se autoriza la candidata de Pfizer, la cantidad de dosis inicialmente será limitada. También quedan muchas incógnitas, incluyendo cuánto tiempo brindará protección la vacuna. Sin embargo, las noticias ofrecen la esperanza de que otras vacunas en desarrollo contra el nuevo coronavirus también puedan resultar efectivas.
“Hoy es un gran día para la ciencia y la humanidad”, afirmó Albert Bourla, presidente y consejero delegado de Pfizer, en un comunicado recogido por Reuters. “Estamos alcanzando este hito crítico en nuestro programa de desarrollo de vacunas en un momento en el que el mundo más lo necesita, con tasas de infección que establecen nuevos récords, hospitales que se acercan al exceso de capacidad y economías que luchan por reabrir”.
“Estoy casi extasiado”, aseveró en una entrevista Bill Gruber, uno de los principales científicos en vacunas de Pfizer. “Este es un gran día para la salud pública y para el potencial de sacarnos a todos de las circunstancias en las que estamos ahora”.
Para ahorrar tiempo, estos grandes laboratorios que realizan la I+D comenzaron a fabricar la vacuna antes de saber si sería eficaz. Pfizer espera producir hasta 50 millones de dosis o suficiente vacuna para proteger a 25 millones de personas este año.
Pfizer ha anunciado que espera producir hasta 1.300 millones de dosis de la vacuna en 2021. Eso significaría protección para 650 millones de personas en el globo, por tanto insuficientes para acabar el año que viene con la pandemia, aunque a la espera de la eficacia de otras candidatas de AstraZeneca, Moderna, Curevac, Janssen, Sanofi y de las distintas iniciativas chinas que tendrán como principal destino el mercado local.
Debido a la noticia, Pfizer subió un 7,69% en la Bolsa de Nueva York, mientras que Biontech sumó 13,91% en el Nasdaq.
Los datos
El laboratorio estadounidense espera obtener una amplia autorización de uso de emergencia de la vacuna en los EE UU para personas de 16 a 85 años. Para hacerlo, deberá haber recopilado dos meses de datos de seguridad sobre aproximadamente la mitad de los 44.000 participantes del estudio, un hito que se espera para fines de noviembre.
Pfizer detalló que el análisis intermedio se realizó después de que 94 participantes en el ensayo desarrollaron Covid-19, examinando cuántos de ellos recibieron la vacuna en comparación con un placebo.
La compañía no desglosó exactamente cuántos de los que se enfermaron recibieron su alternativa. Aun así, más del 90% de efectividad implica que no más de 8 de las 94 personas que contrajeron la patología habían recibido la vacuna, que se administró en dos inyecciones con aproximadamente tres semanas de diferencia.
La tasa de eficacia está muy por encima del 50% de efectividad requerido por la FDA (la agencia del medicamento de EE UU) para una vacuna contra el coronavirus. Sin conocimiento previo de un producto totalmente nuevo, no se conocía cuál podía ser esa eficacia, y los expertos señalaban que sería una buena noticia superar el 60%. La candidata de Pfizer se encuentra actualmente en fase III (pruebas en miles de pacientes) en la que se evalúa su eficacia. Si consigue finalmente demostrar esa efectividad será autorizada para su distribución comercial. La compañía, de momento, no ha informado del precio.
Para confirmar su tasa de eficacia, Pfizer aclaró que continuará el ensayo hasta que haya 164 casos entre los participantes. Dado el reciente aumento en las tasas de infección en Estados Unidos, ese número podría alcanzarse a principios de diciembre, apuntó el científico Gruber.
Los datos aún no han sido revisados por pares ni publicados en una revista médica. Pfizer explicó que lo haría una vez que tenga los resultados de toda la prueba.
Pfizer y BioNTech cuentan un contrato de 1.950 millones con el gobierno de los EE UU para entregar 100 millones de dosis de vacunas a partir de este año. También han alcanzado acuerdos previos de suministro con la Unión Europea, Reino Unido, Canadá y Japón.
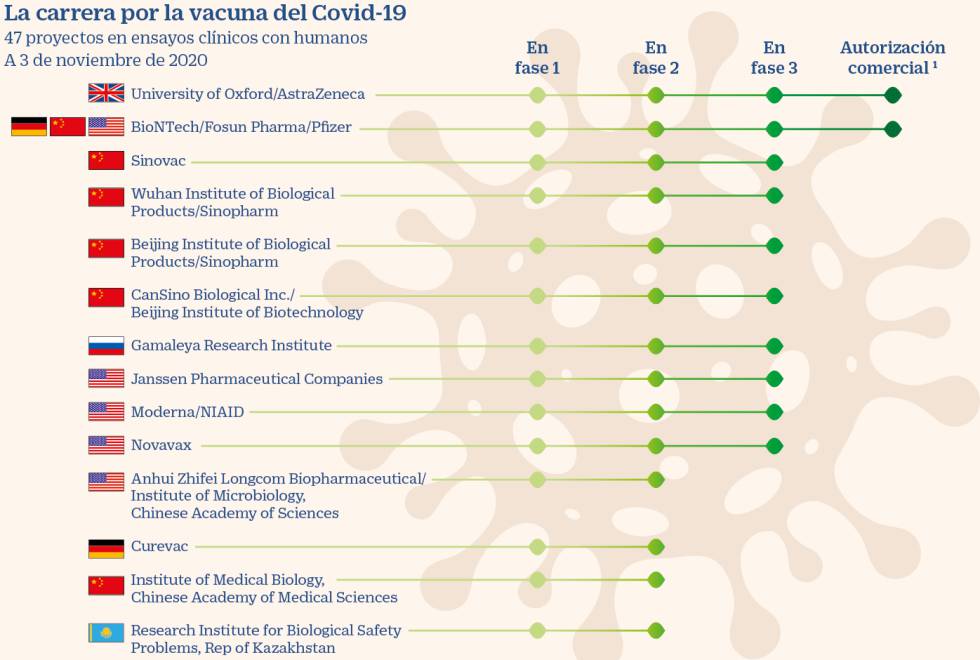
En la actualidad, existen 47 vacunas en estudios en humanos, según recoge la Organización Mundial de la Salud. Entre las más avanzadas están las de Pfizer, Moderna, Janssen, Novavax y Curevac, que en principio serán las que se distribuyan en países europeos si tienen éxito, ya que siguen la evaluación de la EMA.
Source link